Инновационные радиофармпрепараты для диагностики в онкологии
|
Эффективность помощи больным напрямую зависит от уровня развития и внедрения в медицинскую практику современных методов ядерной медицины, которые позволяют диагностировать функциональные отклонения жизнедеятельности органов на самых ранних стадиях болезни
Заведующий лабораторией, руководитель производства радиофармпрепаратов Физико-технического института Томского политехнического университета, профессор, доктор технических наук Виктор Скуридин
Заместитель директора по научной работе и инновационной деятельности Томского НИИ онкологии, профессор Владимир Чернов
Заместителя директора по научно-исследовательской работе Томского НИИ кардиологии, член-корреспондент РАН, профессор Юрий Лишманов
Своевременная диагностика и выявление злокачественных новообразований на ранних стадиях развития остаются одними из актуальнейших проблем современной медицины. Ежегодно в России впервые выявляется около 480 тысяч случаев злокачественных новообразований. В этой связи разработка инновационных радиофармацевтических препаратов (РФП) для молекулярной визуализации представляет собой очень актуальную задачу. На сегодняшний день этой проблемой активно занимается Национальный исследовательский Томский политехнический университет в тесном контакте с Томским НИИ онкологии и НИИ кардиологии СО РАН, где впервые были синтезированы меченные 99mТс наноколлоидные препараты на основе модифицированных производных ДТПА и железоуглеродных частиц, а также меченные 99mТс антибиотики фторхинолонового ряда норфлоксацин и ципрофлоксацин. За последние 3 года здесь также впервые проведены разработка и доклинические испытания наборов реагентов в виде лиофилизатов к генератору технеция-99м для получения еще трех уникальных РФП: наноколлоида 99mTc-Al2O3, производной глюкозы 99mTc-1-тио-D-глюкоза и антибиотика 99mТс-Доксорубицин.
В современной медицине радиоактивные коллоидные наноматериалы нашли применение для мечения аутолейкоцитов с целью диагностики воспалительных процессов, выявления «сторожевых» лимфатических узлов (СЛУ) у онкологических больных и лимфосцинтиграфии. Данный метод обладает высокой чувствительностью в сочетании с высоким разрешением получаемых сцинтиграфических изображений и минимальной радиационной нагрузкой на организм. При этом коллоид с размером частиц менее 50 нм может накапливаться не только в СЛУ, но и в лимфатических узлах второго и третьего уровней, что снижает точность диагностики. В то же время частицы, имеющие размер более 100 нм, медленно мигрируют с места инъекции. Поэтому задача состояла в разработке меченого наноколлоида с размерами в пределах 50–100 нм.
Все известные наноколлоидные препараты изготавливаются на основе соединений, образующих устойчивые гидрозоли. Большая часть из них представляет собой простые неорганические комплексы 99mТс с сульфидами рения и сурьмы, получаемые по достаточно сложным технологиям. На стадии предварительных исследований нами было установлено, что устойчивые коллоидные соединения с заданными размерами могут быть получены более простым способом – путем проведения адсорбции восстановленного 99mTc на нанопорошке гамма-оксида алюминия. При этом величина адсорбции радионуклида на поверхности оксида превышает 93%.
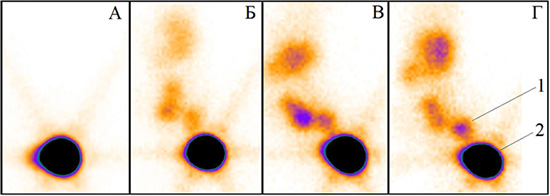
Основными предпосылками для использования гамма-оксида Al2O3 в качестве транспортирующего агента метки 99mТс является его более низкая токсичность, чем у сульфидов, в сочетании с хорошими адсорбционными свойствами, доступностью и низкой стоимостью. В результате проведенных исследований был разработан лиофилизат, основными компонентами которого кроме Al2O3 являются олова дихлорид, аскорбиновая кислота и желатин. Препарат готовят путем введения во флакон с лиофилизатом элюата технеция-99м с последующей кратковременной инкубацией смеси. На рис. 1 приведены сцинтиграммы тела животного, полученные в различные промежутки времени. Цифрами обозначено: 1 – лимфатический узел; 2 – место введения препарата.
Рис. 1. Распределение препарата в организме крысы сразу после введения препарата (А); через 30 мин (Б); через 60 мин (В); через 120 мин (Г)
На сцинтиграммах, соответствующих временным интервалам 60 и 120 мин, отчетливо просматривается «сторожевой» лимфатический узел, расположенный между мочевым пузырем и местом введения препарата. При этом уровень накопления препарата в лимфатическом узле составляет 4,63% от общей введенной активности, что достаточно для его надежной визуализации. Полученный результат превышает стандартные требования к подобным препаратам по уровню накопления 0,5–1,7%.
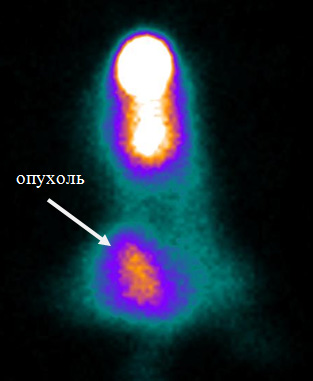
Также высокой информативностью для ранней диагностики злокачественных новообразований отличаются РФП на основе производных глюкозы, меченных радиоактивными изотопами. Это связано с тем, что в клетках опухоли отмечается повышенный уровень метаболизма глюкозы по сравнению с нормальными клетками. В настоящее время в России используется РФП на основе производной 2-фтор-2-дезокси-D-глюкозы (18F-ФДГ),содержащий позитрон-излучающий радионуклид фтор-18. Несмотря на высокую диагностическую информативность ПЭТ с использованием 18F-ФДГ,широкое применение этого метода ограничено из-за его высокой стоимости, а также небольшого количества в стране ПЭТ-центров. В то же время в России существует более 200 центров для проведения однофотонной эмиссионной компьютерной томографии с помощью гамма-камер. Наиболее часто используемым радионуклидом здесь является технеций-99м. Поэтому разработка РФП на основе производных глюкозы с технецием-99м сделает эти препараты доступными для населения на всей территории страны. Кроме того, это позволит значительно увеличить объем исследований и снизить стоимость диагностических процедур. Исследования по синтезу меченных технецием-99м производных глюкозы были проведены на трех ее производных, содержащих в структуре атомы азота и серы, – это D-глюкозамин, 5-тио-D-глюкоза, 1-тио-D-глюкоза. Лучший результат был получен при введении метки технеция-99м в 1-тио-D-глюкозу. На ее основе был разработан состав лиофилизата, который при смешивании с элюатом технеция-99м обеспечивал выход меченого комплекса более 94% при радиохимической чистоте препарата 99,5%. Медико-биологические испытания этого РФП были проведены в Томском НИИ онкологии (рис. 2).
Рис. 2. Сцинтиграмма мыши с привитой в область бедра карциномой Льюиса (LLC)через 30 мин после инъекции РФП99mТс-1-тио-D-глюкозаой
Индивидуализация лечения злокачественных опухолей в соответствии со спектром молекулярных нарушений в каждой опухоли и особенностями лекарственной чувствительности каждого пациента наиболее перспективная стратегия в современной онкологии, которая позволит добиться максимальной эффективности противоопухолевой терапии, избежать многих серьезных побочных эффектов и оптимизировать государственные затраты на лекарственные препараты и лечебные методики, включая наиболее дорогостоящие из них.
Одним из подходов к расширению возможностей методов ядерной медицины для диагностики онкологических заболеваний является создание туморотропных РФП на основе меченных технецием-99м противоопухолевых антибиотиков. В настоящее время из противоопухолевых антибиотиков наибольшее практическое применение имеют антрациклиновые антибиотики, в том числе доксорубицин, который многие десятилетия является одним из самых популярных химиотерапевтических препаратов при лечении злокачественных новообразований. В комбинации с другими противоопухолевыми препаратами он используется примерно у половины онкологических пациентов России. При этом примерно в трети случаев лечение оказывается неэффективным, что с учетом довольно высокой токсичности доксорубицина требует разработки новых подходов к персонификации назначения этого лекарственного средства. Создание нового технециевого РФП на основе доксорубицина позволит получать более достоверную информацию о реакции опухоли на этот препарат и прогнозировать эффективность использования доксорубицина для терапии у каждого конкретного пациента.
Предварительные исследования радиофармацевтического препарата «Доксорубицин,99mТс» на лабораторных животных показали, что индикатор активно накапливается в привитых злокачественных новообразованиях мышей (более чем в 2 раза по сравнению с контралатеральной стороной). Оценка острой токсичности РФП выявила, что ЛД50 «Доксорубицина,99mТс» у крыс составляет 5 мг/кг, что в 4 тысячи раз меньше диагностической дозы. В заключение следует добавить, что разработка представленных препаратов для диагностики в онкологии проведена благодаря финансированию исследований, проводимых в рамках выполнения ФЦП «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу» («Фарма-2020»), а также ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы», средства промышленных партнеров. Над проблемами получения РФП активно работают молодые специалисты. По результатам исследований защищено четыре и готовится к защите три кандидатские диссертации.
ФТИ ТПУ 634028, г. Томск, Кузовлевский тракт, д. 48, стр. 2 к.127 Тел.: (3822) 72-37-71 E-mail: svs1946@rambler.ru Сайт: http://www.tpu.ru
Томский НИИ онкологии 634050, г. Томск, пер. Кооперативный, д. 5 Тел.: (3822) 51-10-39 E-mail: nii@oncology.tomsk.ru Сайт: http://www.oncology.tomsk.ru
Томский НИИ кардиологии 634012, г. Томск, ул. Киевская, д. 111а Тел.: (3822) 55-60-18 E-mail: sv@cardio-tomsk.ru Сайт: http://www.cardio-tomsk.ru
|
|
   |